fosfor
| egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Rent generellt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Namn , symbol , atomnummer | Fosfor, P, 15 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategori | Icke-metaller | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupp , period , block | 15 , 3 , sid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | vitbeige (W) mörk röd (R) svart (S) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-nummer |
7723-14-0 (röd) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG -nummer | 231-115-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA InfoCard | 100.028.286 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massfraktion av jordens kuvert | 0,09% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atom | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomisk massa | 30.973761998 (5) et al | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradie (beräknad) | 100 (98) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radie | 107.00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radie | 180.00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | [ Ne ] 3 s 2 3 p 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Joniseringsenergi | 10.486 686 (15) eV ≈ 1 011.81 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Joniseringsenergi | 19: e.76949 (4) eV ≈ 1 907.47 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Joniseringsenergi | 30: e.20264 (9) eV ≈ 2 914.11 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Joniseringsenergi | 51.44387 (12) eV ≈ 4 963.58 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Joniseringsenergi | 65.02511 (12) eV ≈ 6 273.97 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiskt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiskt tillstånd | fast | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ändringar | 6: e | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | ortorhombisk (svart) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| densitet | vit: 1,83 g / cm 3 röd: 2,0 ... 2,4 g / cm 3 svart: 2,69 g / cm 3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetism |
diamagnetisk (röd: Χ m = −1,9 10 −5 svart: = −2,9 10 −5 ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smältpunkt | vit: 317,3 K (44,2 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| kokpunkt | vit: 553,2 K (280 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molär volym | 17.02 · 10 −6 m 3 · mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Avdunstningsvärme | 51,9 kJ / mol (P 4 ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smältvärme | 0,64 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ångtryck | röd: 3900 Pa vit: 3300 Pa vid 293 K |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifik värmekapacitet | röd: 685,6 J kg −1 K −1 vid 298 K. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Värmeledningsförmåga | 0,236 W m −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiskt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstillstånd | ± 3, 4, 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronnegativitet | 2.19 ( Pauling -skala ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotoper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| För andra isotoper, se listan över isotoper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR -egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| säkerhets instruktioner | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Schweiz: 0,02 mg m −3 (vit / gul fosfor, inhalerbart damm ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toxikologiska data |
Vit fosfor |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Så långt det är möjligt och vanligt används SI -enheter . Om inte annat anges gäller de givna uppgifterna för standardvillkor . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Fosfor (från forngrekiska φωσφόρος phōsphóros , tyska '' ljusbärande '' , från den vita fosforens glöd vid reaktion med syre ) är ett kemiskt element med symbolen P och atomnumret 15. I det periodiska systemet är det i den femte huvuden grupp , eller 15. IUPAC -Grupp eller kvävegrupp .
Fosfor förekommer i flera, mycket olika modifieringar . De vita fosfor består av P 4 molekyler är det enklaste att producera, men termodynamiskt inte den mest stabila modifikationen.
Fosforföreningar är avgörande för alla levande saker och är involverade i strukturer och funktion av organismer i centrala områden som DNA och cellulär energiförsörjning ( ADP / ATP ). Den biogeokemiska omvandlingen av fosfor sker inom ramen för fosforcykeln .
berättelse




Fosfor upptäcktes 1669 av Hennig Brand , en tysk apotekare och alkemist , när han avdunstade urinen till torrhet på jakt efter " Philosopher's Stone " . När den torra urinresten, som - som är känd idag - också innehåller fosfater (salter av fosforsyra), lyser i en eld i frånvaro av luft - det vill säga i frånvaro av ett oxidationsmedel - minskningen av fosfaterna med det organiska föreningar som också finns i urinen resulterade i vitare reduktionsmedel Fosfor som glödde i mörkret på grund av dess kemiluminescens .
Även om fosfor inte användes förutom som en nattlampa vid den tiden, vägdes det mot guld . Hennig Brand blev inte rik av denna upptäckt och sålde receptet till alkemisten Johann Daniel Kraft , som i sin tur tjänade en förmögenhet med det. Han demonstrerade produktionen av fosfor 1677 före Robert Boyle . Det är anmärkningsvärt att Hennig Brand också presenterade sin fosfor i Hannover för forskaren och filosofen Gottfried Wilhelm Leibniz , som skrev en dikt av entusiasm om den mystiska ljusbäraren "Phosphorus Mirabilis".
Vit fosfor användes ursprungligen som ett botemedel på grund av dess kemiluminescens . Efter 1830 blev det mycket viktigt vid tillverkning av tändstickor . Eftersom vit fosfor är mycket giftigt, förgiftades dock arbetare som kommer i kontakt med det ofta allvarligt. Fosforångorna trängde främst in i kroppen genom skadade tänder och ledde till fosfornekros, särskilt i käken . Fosforkäke, engelsk phossy käke , var en av de första yrkessjukdomarna som diagnostiserades som sådan.
Vit fosfor spelade en roll som ett vapen i militärhistorien . Den användes som fyllnadsmaterial för brandbomber , de så kallade fosforbomberna . Det brittiska flygvapnet använde en blandning av vit fosfor och gummi under andra världskriget . På grund av gummit fastnar den viskösa massan och är därför svår att ta bort. Det orsakade dåligt läkning av sår på huden.
Kemister upptäckte tidigt att vit fosfor blev röd när den utsattes för ljus, även i vakuum. Jöns Jakob Berzelius misstänkte att detta var en modifiering av vit fosfor, som först bevisades 1847 av Anton Schrötter von Kristelli (Anton Schrötter) i Wien, som isolerade och analyserade ämnet. Violett fosfor upptäcktes av Johann Wilhelm Hittorf 1865 . och boktrycksvarianten svart fosfor Percy Williams Bridgman 1914.
Förekomst
På jorden, särskilt i jordskorpan, förekommer fosfor uteslutande i bunden form, det vill säga inte nativt, mestadels i form av fosfater (innehåll i jordskorpan: ~ 0,09%, cirka 1,2 kg per ton). Typiska mineraler är apatiterna Ca 5 (PO 4 ) 3 (F, Cl, OH). Speciellt fluorapatit och fosforit varvat med kalciumkarbonat är de viktigaste fosfaterna ur ekonomisk synvinkel Det finns också andra fosforinnehållande mineraler, såsom wavellit Al 3 (PO 4 ) (F, OH) · 5 H 2 O , Vivianite Fe 3 (PO 4 ) 2 · 8 H 2 O och den turkosa CuAl 6 [(PO 4 ) (OH 2 )] 4 · 4 H 2 O.
De största fosfatmineralerna finns i Afrika, Kina och USA ( Florida ). Fyra länder har cirka 80% av världens fosfatbergreserver som kan brytas ekonomiskt med dagens teknik : Marocko (tillsammans med Västsahara 36,5%), Kina (23,7%), Jordanien och Sydafrika (9,6% vardera). De kontinentala insättningarna räcker bara i några decennier; Uppskattningar från 2000 -talet varierar mellan 50 (2008) och 130 år (2006). Som en följd av de nyligen hittade insättningarna främst i Nordafrika och Irak antar en uppskattning från den tyska regeringen från 2012 att ingen brist är nära förestående och att de aktier som hittills är kända kommer att pågå fram till omkring år 2400. Det finns också stora avlagringar under vatten, som för närvarande inte kan brytas ekonomiskt.
Förutom mineraler, är fosfor också i avsättningar av fågelspillning från havsfåglar , den så kallade guano (innehåller 7-8%, sällan upp till 60% Chile nitrat och högst omkring 40% fosfater). Detta finns främst på vissa öar i Stilla havet, såsom Nauru eller Kiribati och i Sydamerika ( Peru / Chile ). Fosforbestånden på Nauru har minskat kontinuerligt sedan mitten av 1970-talet och är nu nästan helt slut.
Avloppsslam innehåller också stora mängder fosfater. Fosforsyran kan återvinnas från avloppsslam genom stadsbrytning .
Av de cirka 180 miljoner ton stenfosfater som utvinns årligen över hela världen (från och med 2010) används cirka 90% för produktion av gödningsmedel . Fosfor kan inte ersättas med något annat ämne i gödningsmedel.
Fosfor har också en viktig betydelse i den organiska världen (som bunden eller partikelbunden organisk fosfat i organismer och i detritus ) och förekommer i olika områden av fauna och flora : till exempel som hydroxylapatit Ca 5 (PO 4 ) 3 OH, vilket är en av huvudkomponenterna i det strukturella ämnet som finns i ben och tänder. Vidare spelar fosforföreningar en viktig roll i levande organismer som komponenter i nukleinsyror och som en komponent i energibäraren ATP och är väsentliga för alla kända levande varelser.
Fosfor bildas i massiva stjärnor när syre bränns från syre vid temperaturer över 1,5 · 10 9 Kelvin och densiteter på minst 10 10 kg / m 3 .
Det antas att den fosfor som är användbar för tidigt levande varelser endast var tillgänglig via meteoriter som kom till jorden under Hadaic -eran . År 2020 använde astronomer data från ALMA och ROSINA för att visa ett sätt för fosfor att bildas: under stjärnbildning i gasmoln som ”AFGL 5142”. De visar också att detta då kunde ha nått jorden via kometer - som Churyumov -Gerasimenko - i form av fosformonoxid. Fosfatet, som redan förekommer på jorden, är inert och svårt att lösa upp och skulle därför endast ha varit av begränsad användning för de första levande varelserna. Däremot reagerar de skriftlärda som meteoriterna tar med sig med vatten för att bilda reducerade fosfider . Dessa skulle vara troliga utgångsmaterial för en prebiotisk syntes av fosforylerade biomolekyler (såsom ribonukleinsyra ).
Extrahering och presentation
Fosfor erhålls från fosfatmineraler som fosforit eller apatit , i vilka dessa värms upp till 1500 ° C i en elektrisk smältningsugn tillsammans med kvartsgrus och omvandlas därmed till vit fosfor. Ugnen är utformad som en sluten lågaxelugn, värmen tillförs via Söderberg-elektroder .
Kolmassan i elektroden fungerar som ett reduktionsmedel och kiseldioxiden i kvarts fungerar som en slaggbildare. Den fosfor som produceras i gasform under processen kondenseras och samlas upp under vatten.
Tillverkare
Efter konkursen hos Thermphos , den sista europeiska tillverkaren, är leveransen av vit fosfor nästan uteslutande baserad på Kazphosphate -företaget , som driver en fabrik i Tschimkent . Andra tillverkare är Monsanto med en fabrik i Soda Springs ( Idaho ) och olika kinesiska företag.
Ändringar och egenskaper
Fosfor förekommer i fyra allotropa modifieringar som vit, röd, svart och lila fosfor. Var och en av dessa grundtyper bildar olika kristallstrukturer . Detta leder till mycket stora skillnader i fysiska egenskaper och reaktivitet.
Eftersom de andra modifieringarna är svåra att få direkt produceras alltid vit fosfor först och detta omvandlas sedan till andra modifieringar. Dessa kan omvandlas till varandra genom högt tryck och hög temperatur. Den svarta fosforen är faktiskt den mest stabila modifieringen vid rumstemperatur, men de andra är metastabila på grund av den långsamma omvandlingsfrekvensen . Vit fosfor kan produceras i laboratoriet genom att värma röd fosfor i frånvaro av syre. Omvänt kan röd fosfor också produceras genom att värma vit fosfor till cirka 180-350 ° C i flera timmar.
Gasformigt tillstånd
I fosforånga dominerar CP 4 tetraeder som de minsta molekylära enheterna under 1200 ° .
PP avstånd i tetraedriska P 4 molekyler är r g = 2,1994 (3) Å, är vinkeln PPP 60 °. Strukturen bestämdes genom gaselektrodiffraktion .
Den grad av dissociation är ~ 1% vid 800 ° C. Mellan 1200 och 2000 ° C dominerar P2- molekyler med en kväve-analog valenselektronstruktur, över 2000 ° C dissocieras dessa slutligen långsamt till atomfosfor med stigande temperaturer.
Vit fosfor
Vit fosfor är den mest flyktiga och reaktiva modifieringen av fosfor. Den har en densitet av 1,82 g / cm 3 , en smältpunkt av 44,25 ° C och en kokpunkt av 280 ° C och är genomskinliga och vaxartad. När den är förorenad är den vita fosforn också känd som gul fosfor . Den kubiska vit fosfor är mycket lättlösligt i fosfortriklorid och kol disulfid CS 2 ; 100 g koldisulfid löser upp mer än 1 kg fosfor. Fosfor är svagt löslig i koltetraklorid , bensen eller eter . Det är praktiskt taget olösligt i vatten.
Vid −76,9 ° C ändras kubisk form (α-form) till en sexkantig form (β-form) (rotation av de fria yttre elektronerna "frusna"). I någon form (α-, β-, i lösning) vitt fosforformer P 4 tetrae med en bindning vinkel av 60 °.
I finfördelat tillstånd antänds vit fosfor av sig själv i luften, från cirka 50 ° C antänds och brinner även kompakta bitar för att bilda fosfor (V) oxid . Därför måste vit fosfor hållas under vattnet. Brinnande fosfor får inte släckas med vatten, eftersom det finns en risk att fosfordammet tvättas till fina sprickor och antänds igen efter att vattnet har avdunstat. Brinnande fosfor släcks bäst med sand.
Vit fosfor kan visa blåaktig kemiluminescens i luften . Detta uppkommer från det gasformiga P 4 närvarande i miljön på grund av det höga ångtrycket av vit fosfor , som reagerar till P 4 O 10 genom gasfasoxidation via P 4 O 6 . Vanligtvis i en våldsam exoterm reaktion kombineras fosfor med halogener, metaller eller svavel. De resulterande föreningarna är fosforsulfider , fosfor (III) eller fosfor (V) föreningar och fosfider . Under verkan av starka alkalier vid höga temperaturer disproportionerar fosfor till fosfin och hypofosfit. Fosfor har en hög affinitet för syre , så det har en stark reducerande effekt . Så z. B. Svavelsyra reducerad till svaveldioxid vid uppvärmning med vit fosfor .
Fosforpentoxiden som bildas när fosfor förbränns är mycket hygroskopiskt och bildar en tjock dimma av fosforsyra med fukt i luften. Vit fosfor används därför i rökgranater.
Vit fosfor är mycket giftigt; så lite som 50 mg kan vara dödligt för en vuxen människa. Döden inträffar först efter fem till tio dagar. Vit fosfor utsöndras också bara långsamt. Den långsamma toxiciteten gör (e) fosfor lämplig som råttgift . För detta ändamål användes så kallade "Phosphorlatwergen". På grund av de allmänna farorna och eftersom mer lämpliga medel finns tillgängliga är vit fosfor föråldrad som ett råttgift.
Toxiciteten hos vit fosfor beror huvudsakligen på dess höga reducerande kapacitet, vilket stör intracellulära oxidativa metaboliska processer som protein och kolhydratsyntes. Detta gäller främst enzymatiskt kontrollerade metaboliska processer i levern. De mycket giftiga fosfinerna som bildas genom reaktion med vatten , som är starka metaboliska gifter och har en speciell affinitet för centrala nervsystemet , utgör en ytterligare fara . Vit fosfor kan göras ofarlig med en koppar (II) sulfatlösning. I processen bildas svagt löslig koppar (I) fosfid .
Sedan 1845 var bland arbetare, främst inom industriell produktion av tändstickor tunga med vit fosfor, käke - nekros observerats ( engelska phossy käke ). På 1800 -talet var arbetare som hanterade fosforbad helt oskyddade (ofta även barn och unga som var upptagna med att packa tändstickorna) snabbt oförmögna att arbeta. Det fanns ingen effektiv terapi. Patienterna var svårt vanställda, ofta arbetslösa, dödligheten var 20%. Det yrkesmässiga medicinska problemet med fosfornekros , särskilt massiv tallnekros, ledde till de första yrkesmedicinska konsekvenserna i modern medicinsk historia. 1906 ledde Bernkonventionen till förbudet mot vit fosfor vid tillverkning av tändstickor. Liknande käknekros kan ses idag med bisfosfonatbehandling ( bisfosfonatassocierad bennekros ).
Svart fosfor
Den mest stabila modifieringen vid rumstemperatur finns i en amorf och tre kristallina former. På grund av dess polymera form är svart fosfor olöslig, signifikant mindre brandfarlig, mycket inert och har en densitet av 2,69 g / cm 3 . Därför, liksom röd fosfor, är svart fosfor giftfri. Kristallgitteret som den svarta fosforn baseras på består av korrugerade dubbla lager där fosforatomerna är pyramidala kopplade till tre andra fosforatomer i närheten vid en bindningsvinkel på 100 °. I denna konfiguration har fosfor halvledande egenskaper . I fuktig luft oxideras svart fosfor lite snabbare än röd fosfor, men det är täckt med en färglös, viskös flytande hud gjord av fosforsyror, så att ytterligare syreåtkomst förhindras och inflammation försvåras. Den normala svarta fosforen kristalliserar ortorombiskt ; vid 80 000 bar förändras detta reversibelt till en rombohedral och vid 110 000 bar till en kubisk metallisk modifiering.
Svart fosfor bildas av vit fosfor under högt tryck (12 000 bar) och förhöjd temperatur (200 ° C) och skiljer sig mycket från den ovan nämnda modifieringen när det gäller dess färg. Det ser gråsort, glänsande och fibröst ut som trä. En lågtrycksmodifiering har också nyligen gjorts.
Röd fosfor
Ett antal amorfa och kristallina former med densitetsvariationer mellan 2,0 och 2,4 g / cm 3 och smältpunkter mellan 585 ° C och 610 ° C är grupperade tillsammans under namnet röda fosforn . Röd fosfor är generellt amorf, men kan omvandlas till monoklinisk hettorfisk (violett) fosfor genom omkristallisation från smält bly , som bildar en tredimensionellt tvärbunden polymerform.
Röd fosfor erhålls genom att värma vit fosfor till cirka 260 ° C i flera timmar i frånvaro av luft. En långsam omvandling sker också när den utsätts för ljus. Jod katalyserar omvandlingen av vitt till rött fosfor.
Skillnaderna mellan de kristallina delarna i röd fosfor avgör de olika formerna av densamma. Kornstorleken , typen av gitter , föroreningar och de olika mättnaderna hos kantgrupperna med halogener , syre och hydroxylgrupper påverkar här .
Även om röd fosfor inte är självantändlig kan den antändas eller till och med explodera med starka oxidationsmedel genom låg energitillförsel (friktion, påverkan). Ett exempel på detta är Armstrongs blandning , som används för att slå säkerhetsmatcher . När det gäller reaktivitet är violett fosfor mer som svart fosfor, medan Schencks fosfor är mycket mer reaktiv än "normal" röd fosfor.
Till skillnad från vit fosfor är röd fosfor inte giftig. Hans första beskrivning tillskrivs Anton Schrötter von Kristelli .
Ljusröd fosfor
Den ljusröda eller Schencks fosfor ( Rudolf Schenck , 1902) produceras genom att koka vit fosfor i fosfortribromid (PBr 3 ). Produkten är en blandad förening av fosfor med 10 till 30% brom, av vilka är densiteten 1,88 g / cm 3 .
Violett / Hittorfs fosfor
Lila fosfor bildas när vit fosfor värms till ca 550 ° C under en till två veckor.
Han upptäcktes av Johann Wilhelm Hittorf . Det är en icke-ledande polymer som är olöslig i CS 2 . Strukturbelysningen lyckades i slutet av 1960 -talet vid universitetet i Stuttgart av Herbert Thurn . Den lila fosforn är också giftfri.
Fosfor nanoroder
I augusti 2004 lyckades tyska forskare isolera och strukturellt karakterisera två ytterligare modifieringar av det mångfacetterade elementet: fosfornanoroder . I dessa två modifieringar finns fosforatomerna i form av kedjemolekyler (polymerer). Upptäckarna av de nya modifieringarna är Arno Pfitzner från University of Regensburg och Hellmut Eckert från Westphalian Wilhelms University i Münster . De rödbruna fibrerna, som skiljer sig markant från den röda fosformodifieringen, är stabila i torrt tillstånd i veckor i luften. Elektronmikroskopi visade denna rödbruna fosforform som långa, parallella nanoroder med diametrar på cirka 0,34 nm (nanometer) till 0,47 nm.
Isotoper
Fosfor har bara en stabil isotop , 31 P; detta är den enda naturligt förekommande isotopen av fosfor. Det är därför ett rent element (anisotopiskt).
Fosfor har flera andra isotoper, som alla är radioaktiva. Fosforisotopen 33 P har den längsta halveringstiden på 25,3 dagar . 32 P har en halveringstid på 14,3 dagar och används i medicin. Det används också som spårämne inom molekylärbiologi . Det kan till exempel användas för att radioaktivt markera genprober och att detektera dem med hjälp av autoradiografi .
använda sig av
De flesta (80%) av den vita fosfor som produceras bränns för att bilda fosfor (V) oxid (P 2 O 5 ), som används som utgångsmaterial för produktion av fosforsyra och för framställning av olika fosfater . Majoriteten av alla fosfater används däremot som gödningsmedel . Fosfor (V) oxid är också viktigt som ett av de mest effektiva uttorkande ämnena ( torkmedel ).
En annan del är fosfortriklorid (PCl 3 ) och fosfor (V) sulfid (P 4 S 10 bearbetad) som basmaterial för produktion av flamskyddsmedel , tillsatser , mjukgörare och bekämpningsmedel .
Röd fosfor används för att göra tändstickor . Paradoxalt nog tillsätts också finfördelad röd fosfor till plast (t.ex. polyamid ) som ett flamskyddsmedel: reaktionsprodukterna av fosfor, atmosfäriskt syre och vatten (fukt, restfukt i plasten) bildar ett förkolnat skyddande lager mot lågorna. Dessutom verkar bildade fosfor -suboxider, t.ex. B. PO, som en radikal avlägsnare och avbryta förbränningen i gasfasen på detta sätt.
Dessutom erhålls fosfaterna, som är viktiga som gödningsmedel, direkt från kalciumfosfat genom att bryta ner det med svavelsyra . Det så kallade superfosfatet produceras . Cirka 60% av världens svavelsyraproduktion krävs för detta.
Röd och vit fosfor används också för militära ändamål. Den mycket giftiga och självantändliga vita fosforn används i brännbar ammunition som fosforbomber och användes tidigare även i rökammunition. I modern rökammunition används dock den giftfria röda fosforn i blandningar med oxidationsmedel och metalliska bränslen. Om dimma är målet, görs ett försök att erhålla den finaste möjliga P 2 O 5 damm , varje partikel av vilka fungerar hygroskopiskt som en kondensations kärna för luftfuktighet. Dimman består sedan av små droppar utspädd fosforsyra, en ganska svag syra.
Fram till 1980 -talet utfördes också experiment med vit fosfor i skolorna, vilket var förbjudet av hälsoskäl. Nu får endast röd fosfor användas i experiment.
Den radioaktiva fosforisotopen 32 P används inom medicin och forskning som spårämne för att observera metaboliska processer (till exempel vid 32P efter märkning ) eller för att behandla sjukdomar, till exempel vid kärnmedicinsk behandling av polycytemi vera . En föråldrad metod för att diagnostisera koroidalt melanom var radiofosfortestet .
I marken
Fosfor kommer naturligt in i jorden genom apatitvittring eller från sönderdelat organiskt material. Atmosfärisk avsättning spelar bara en underordnad roll med fosfor. Fosfor är ett viktigt kärnämne . Med konstgödsel ökar människor fosforhalten i jorden. Erosion kan betraktas som huvudfaktorn i förlusterna. Den direkta urlakningen i grundvattnet är mycket låg och bortsett från försumbara mängder fosfingas kommer det ingen avgasning från marken. Fosfat har en mycket dålig löslighet . Till exempel adsorption av Fe- och Al -hydroxider i sura jordar leder till fosfatfixering. Nederbörd med kalcium förekommer i grundjord .
I allmänhet kan fosfatfraktioner i jorden klassificeras på olika sätt. Två ofta använda klassificeringar är klassificering enligt löslighet och klassificering enligt fosfattyper.
Klassificering av tre olika fosfatfraktioner i jorden efter löslighet:
- Fosfat som finns i marklösningen är direkt tillgängligt för växter. Detta är dock den minsta fraktionen med 1-2 kg / ha.
- Instabilt fosfat är löst bundet till järn- och aluminiumoxider eller till lermineraler genom specifik sorption. 450–900 kg / ha kan alltså finnas i jorden. Växt tillgängligt fosfat kan bildas av denna fraktion genom absorption.
- Stabilt fosfat har praktiskt taget ingen betydelse för växtnäring, men med 3000–6000 kg / ha är det den största av de tre fraktionerna. De viktigaste representanterna här är apatiter och kalciumfosfater.
Dessa fraktioner är i en dynamisk jämvikt med varandra och kan ibland smälta in i varandra under mycket långa tidsperioder.
Klassificering av tre olika fosfatfraktioner i jorden efter fosfattyperna:
- Oorganiskt fosfat är den fraktion som finns i primära fosformineraler (t.ex. apatit ), i sekundära fosformineraler ( Fe- , Al- eller Ca -mineraler ) eller adsorberas på Fe- och Al -hydroxider .
- Upplöst fosfat är andelen som finns i upplöst form i jordlösningen som H 2 PO 4 - eller som HPO 4 2− . Upplöst fosfat är direkt tillgängligt för växter.
- Organiskt fosfat är en samlingsbeteckning för alla andra organiska föreningar som finns i jorden. Detta inkluderar fosfor i humus, fosfor adsorberat på organiska molekyler, mikrobiell fosfor och fosfor i växtrester.
Den tidpunkt då den maximala globala fosfatproduktionen uppnås kallas toppfosfor .
Biologisk betydelse
fysiologi
Fosfor är viktigt för alla biologiska organismer. Fosforföreningar är en del av DNA- och RNA -molekylerna, bärarsubstansen för den genetiska informationen om alla levande saker. Den höga fosforföreningen adenosintrifosfat spelar en avgörande roll i energimetabolismen (aktiverat socker) i cellerna. Fosfor finns också i sockerfosfater, fosfolipider och koenzymer . Den fosforylering är en nyckelregleringsmekanismer i organismer. Fosfater är också en integrerad del av pH -buffertsystemet i blodet .
Torrsubstansen hos markväxter innehåller 0,15% till 0,50% fosfor, däggdjur som människors cirka 4%. Ramen för ben och tänder består huvudsakligen av hydroxiapatit (Ca 5 (PO 4 ) 3 OH). Kroppen hos en person som väger 70 kg innehåller cirka 700 gram fosfor, varav 600 g är fast bundna i bensystemet.
Det dagliga behovet för en vuxen är cirka 0,75 gram fosfor; Det är särskilt rikligt i mejeriprodukter, kött, fisk och bröd. Tillgängligheten av fosfat fungerar ofta som en begränsande tillväxtfaktor för växter, varför stora mängder gödningsmedel som innehåller fosfat måste appliceras i jordbruket.
Vit fosfor och fosforföreningar som fosfin och många fosforsyraestrar är mycket giftiga.
växter
Fosfor fyller olika väsentliga funktioner i växter. Det är en del av lipider och därför ett strukturellt element. I DNA och RNA är det bron mellan två riboser . Kovalent bunden till adenosin , det fungerar som en universell form av energiöverföring i celler. Dessutom har fosfor påverkan på kolhydratbalansen, fotosyntesen och växternas vattenbalans.
För att göra den fosfor som finns i marken tillgänglig för metabolism, växter har för att frigöra organiskt eller oorganiskt bundna fosfor, som de kan absorbera som H 2 PO 4 - . Detsamma gäller mikroorganismer och svampar som lever i jorden. Många mikroorganismer, svampar och växter släpper ut enzymer i jorden, som hydrolyserar de organiska fosforsyraestrarna och därmed frigör oorganiskt fosfat, som kan absorberas och metaboliseras av organismerna. Dessa enzymer kallas fosfataser . Beroende på fosfatasets optimala pH -område skiljer man mellan sura (pH 4-5) och basiska fosfataser. Om växten absorberar mer fosfat än den kan använda i lipider, nukleinsyror och bunden till adenosin, lagrar den överskottet som en organiskt bunden form i vakuolerna . Fosfataser hjälper också vid denna tidpunkt att omvandla fosfatet tillbaka till den oorganiska fria formen.
Om växter lider av fosfatbrist visar de olika symptom. Bladytorna reduceras och habitus reduceras totalt sett; Antocyaninfärgning kan förekomma och nekros kan utvecklas. På grund av ansamling av stärkelse i kloroplasterna blir bladen "styva". Utvecklingen av blommor, frön och frukter minskar eller försenas. Eftersom klorofyllsyntesen inte reduceras lika mycket med fosfatbrist som andelen bladyta minskar, sker hyperklorofyllering i bladen, vilket uttrycks av en djupgrön färg.
Eftersom fosfatkoncentrationen kraftigt reduceras i rhizosfären , särskilt i området en till två mm runt roten, reagerar vissa växter på fosfatbrist med ökad rottillväxt.
ekologi
Fosforcykeln eller fosforcykeln är den konstanta migrationen och biogeokemiska omvandlingen av bioelementfosfor i vatten, i jord och i biomassa.
På grund av fosfats centrala ekologiska betydelse spelar kvantitativ fosforanalys också en viktig roll vid utövandet av kemisk vatten- och markövervakning, till exempel vid bestämning av fosfatföroreningar (ökad fosfatkoncentration) i vatten från överbefruktade jordbruksområden i område.
bevis
Spektroskopiskt
Den valda metoden för detektering av fosforföreningar är 31 P- NMR- spektroskopi. 31 P är den enda naturligt förekommande fosforisotop och har en kärnspinnkvantnummer av 1/2. Jämfört med väte är den relativa känsligheten bara 6,6%. Resonansområdet är cirka 700 ppm (P 4 har till exempel ett skift på -520 ppm). 85% fosforsyra kan användas som standard. Eftersom fosfor är en spinn 1/2 kärna kan spektra utvärderas mycket bra. Om vätet också är frikopplat resulterar vanligtvis en skarp signal. Fosforförskjutningen är mycket beroende av dess bindningspartner, så den är mycket väl lämpad för identifiering av kända föreningar. När det gäller okända föreningar är det informativa värdet ofta begränsat, eftersom en föreningsklass endast sällan kan tilldelas uteslutande ett spektralområde.
| Derivat med | Kemisk förskjutning (δ i ppm) |
|---|---|
| 3-strängad P | −180 till +200 |
| 4-strängad P | −120 till +130 |
| 5-strängad P | −100 till −20 |
| 6-strängad P | −220 till −130 |
Våt kemikalie
Den kvantitativa och kvalitativa bestämningen av fosfor sker via fosfatet ( närmare bestämt ortofosfat PO 4 3− ). För detta ändamål omvandlas bunden fosfor till fosfat genom att oxidera matsmältningen, om det behövs .
Kvalitativa bevis
Vid detekteringsreaktionen med natriummolybdat erhålls en gul lösning av natriummolybdofosfat i sur lösning ; ett färgreagens framställt av upplöst askorbinsyra sätts till lösningen och upphettas i ett vattenbad. Detta resulterar i molybdenblått , som kan bestämmas kvantitativt och fotometriskt.
Vid detekteringsreaktionen med ammoniumheptamolybdat erhålls en gul fällning av ammoniummolybdofosfat i sur lösning . Med hänsyn till att heptamolybdat går in i en jämvikt i vattenlösning:
följande reaktionsekvationsresultat:
I alkalisk lösning av ammoniak fosfat faller i närvaro av magnesium - joner såsom magnesium ammoniumfosfat från:
Beviset kan också utföras i form av zirkoniumvätefosfat :
Som anges i många läroböcker är formuläret Zr 3 (PO 4 ) 4 felaktigt; denna förening bildas inte i vattenlösningar!
Historiskt sett är Mitscherlich -provet intressant för detektering av vit fosfor, som främst användes vid misstänkt fosforförgiftning. Innehållet i magen värms upp med vatten, och den vita fosforen, som är flyktig med vattenånga, kondenseras sedan och när den kommer i kontakt med atmosfäriskt syre, tänds den ( kemiluminescens ).
För strukturstudier av föreningar innehållande fosfor är 31 P kärnmagnetisk resonansspektroskopi lämplig .
Kvantitativa bevis
Gravimetri
För en gravimetrisk bestämning kan en gul molybdofosfatjon bildas av fosfat- och molybdatjoner i en stark saltsyralösning :
Med 8-hydroxikinolin ( kallad HOx eller oxin i korthet ) bildas en svagt löslig fällning av oxin-12-molybdo-1-fosfat, som sedan torkas vid 160 ° C och vägs i vattenfri form.
- Nederbörd:
- Vägningsform:
- (Färg: mörk orange)
Den grovkristallina fällningen innehåller endast 1,37% fosfor. Detta innebär att mindre mängder fosfat lätt kan bestämmas (se mikromolmetoden ).
Volymetri
Volymetriska fosfatbestämningar är utfällning med La 3+ eller Bi 3+ - standardlösningar och efterföljande baktitrering med EDTA utfört.
Kolorimetri / fotometri
För bestämning av låga koncentrationer av fosfat i sötvattenprover bildas ett djupblått antimon-fosfor-molybdatkomplex, som endast får sin intensiva färg av ett reduktionsmedel, vanligtvis askorbinsyra . Detta möjliggör känsliga bevis ner till intervallet ca 0,6 mg PO 4 / l (ca 0,2 mg P / l).
Förfarandet är standardiserat i EN ISO 6878 (tidigare EN 1189 eller DIN 38405 D11).
säkerhets instruktioner
Vit fosfor
Vit fosfor kan antändas i luft om den är finfördelad. Självantändningstemperaturen är cirka 34 ° C, vilket är relativt nära rumstemperatur. Reaktionen mot fosforpentoxid är starkt exoterm . Giftiga fosfiner kan bildas med vatten och alkalihydroxider . Starka oxidationsmedel reagerar vanligtvis explosivt.
Kassering av ammunition innehållande fosfor efter andra världskriget i grunda delar av Östersjön leder upprepade gånger till allvarliga skador och dödsfall. De bärnstensfärgade klumparna av fosfor tvättas upp och därmed äventyras särskilt fiskare och turister. Enligt statistiken dog 168 personer av ammunitionsrester i Östersjön efter andra världskriget, 250 personer skadades, några allvarligt. Experter antar nu till och med att siffrorna är betydligt högre.
Akut förgiftning med vit fosfor ( fosforförgiftning ) manifesterar sig i gastrointestinala störningar, leverskador med allvarliga metaboliska störningar och skador på hjärta och njurar. Kronisk förgiftning, även i små mängder, kan leda till allmänna välbefinnande och skador på blod och ben ( osteoporos ), särskilt i käken.
Doser på 15 mg eller mer av vit fosfor kan orsaka allvarliga toxiska effekter. Mängder från 50 mg (~ 1 mg / kg kroppsvikt) kan vara dödliga .
Skolförsök med vit fosfor, som fosforklocka -experimentet , är inte tillåtna enligt nyare bestämmelser; vit fosfor får inte lagras i skolor på grund av dess farlighet.
Andra ändringar
De andra kända modifieringarna av fosfor är giftfria i sin rena form på grund av deras olöslighet i vatten och lägre reaktivitet. De antänds också bara vid en högre temperatur (röd fosfor endast vid 260 ° C).
länkar
Fosfor är mycket reaktiv och bildar kovalenta bindningar med ett stort antal icke-metaller . Det förekommer i alla oxidationstillstånd mellan -3 och +5 och koordinationsnumren 1 till 6, mestadels 3 till 4. Oxidationssiffrorna −3 och +5 föredras.
Väteföreningar
Fosfaner (det gamla namnet fosfin är inte längre IUPAC- kompatibelt, men används nästan uteslutande i kemisk litteratur, särskilt i anglosaxiska) betecknar föreningar av trivalent fosfor med väte eller ersättning av en eller flera väteatomer med organiska grupper som bindningspartner . Den organiska gruppen måste anslutas direkt till fosforatomen via kolstommens kolatomer. Om den organiska gruppen är bunden till fosforatomen av en syreatom (dvs enhet POC, t.ex. i P (OPh) 3 ), talar man om fosforsyraestrar eller fosfiter .
Oxider
Med syre bildar fosfor olika föreningar med den allmänna formeln P 4 O n (n = 6-10, 18), eftersom fosfor kan finnas i flera oxidationstillstånd. Både fosfor-syre enkelbindningar och dubbelbindningar samt överbryggande fosfor-syre-fosforbindningar är möjliga.
Fosforoxider bildar strukturer som liknar adamantan :
- Fosfortrioxid P 4 O 6 är en vit, mjuk förening som är mycket giftig och reaktiv och snabbt reagerar för att bilda fosforpentoxid.
- Fosfortetraoxid P 2 O 4 är en blandad oxid. Det kan erhållas genom att oxidera fosfortrioxid till koltetraklorid .
- Fosforpentoxid P 4 O 10 är den viktigaste fosforoxiden. Det är mycket hygroskopiskt och används som torkmedel .
Det finns också andra fosforoxider som inte kan isoleras under normala förhållanden. Av dessa är fosformonoxiden PO förmodligen den vanligaste fosforhaltiga molekylen i interstellära moln .
Oxosyror och salter
Ett stort antal fosfor- syresyror och deras motsvarande salter med en eller flera fosforatomer kan härledas från dessa oxider :
| Oxideringsnivå av fosfor |
Strukturformel | Namnet på syran | Salternas namn | |
|---|---|---|---|---|
| Monofosforsyror | ||||
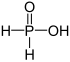
| + Jag | Fosfinsyra | Fosfinater | ||
| + III | Fosfonsyra | Fosfonater | ||
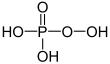
| + V | fosforsyra | Fosfater | ||
| + V | Peroxomonofosforsyra | Peroxomonofosfater | ||
| Difosforsyror | ||||
| + II | Hypodifosfonsyra | Hypodifosfonater | ||
| + III | Difosfonsyra | Difosfonater | ||
| + IV | Hypodifosforsyra | Hypodifosfater | ||
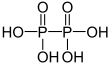
| + V | Difosforsyra | Difosfater | ||
| + V | Peroxodifosforsyra | Peroxodifosfater | ||
Det finns också svavelinnehållande derivat av dessa syror, t.ex. B. tiofosforsyra , vars salter kallas tiofosfater .
Det finns också ett antal fosfor mineraler , den viktigaste av dessa är hydroxyapatit och fluorapatit . Ytterligare fosformineraler finns i kategorin: fosformineral .
Halogenföreningar
Fosfor bildar ett stort antal föreningar med halogeniderna fluor , klor , brom och jod . De viktigaste anslutningstyperna är PX 3 , P 2 X 4 och PX 5 . Fluorföreningarna är gasformiga, klorföreningarna är mestadels flytande, brom och jodföreningar är fasta. Många fosforhalogenföreningar är giftiga. Alla föreningar är känsliga för hydrolys och måste skyddas från fukt under lagring.
Exempel på denna klass av föreningar är fosfortriklorid , fosforpentaklorid , difosfortetrafluorid och fosfortrijodid . Syre- och svavelhalogenföreningar av typen POX 3 (t.ex. fosforoxiklorid ) och PSX 3 , liksom polymeroxidhalogenider av typen (POX) n är också kända . Halogeniderna av fosfor är bland de första icke-metalliska halogeniderna som undersöktes av forskare som Joseph Louis Gay-Lussac , Humphry Davy och Pierre Louis Dulong i början av 1800-talet .
Andra oorganiska föreningar
Fosfor och svavel bildar ett antal fosforsulfider, som i sin struktur z. T. liknar fosfor- syreföreningarna . Strukturen är baserad på ett P 4 tetraeder, är kanterna och spetsarna av tetraeder ockuperade annorlunda med svavelatomer. De har den allmänna formeln P 4 S x (x = 3–10). De tillverkas genom att värma röd fosfor och svavel i lämpliga proportioner. Fosforpentasulfid (P 4 S 10 ) är den viktigaste av dessa. Tetrafosfortrisulfid (P 4 S 3 ) används fortfarande delvis för tändstickans tändmaterial . Föreningar med selen är också kända.
Kväve och fosfor bildar nitrider med sammansättningen PN och P 3 N 5 . Fosfornitrilklorider (fosfortnitrildiklorider) är inte kända i det monomera tillståndet. De har den allmänna formeln (PNCl 2 ) x med en ring- eller kedjestruktur. De härrör från reaktionen av ammoniumklorid med fosforpentaklorid och tillhör gruppen fosfazener, föreningar med den allmänna formeln (PNH 2 ) x . Polydiklorfosfazen har egenskaper som syntetiskt gummi , men det är instabilt. Genom att ersätta kloratomerna med alkoxigrupper eller perfluoroalkoxigrupper erhålls emellertid kemiskt och termiskt stabila polymerer med elastomera egenskaper.
Organiska föreningar

Bland de organiska fosforföreningarna kan man skilja mellan dem med en fosfor-kolbindning och de som inte har en fosfor-kolbindning. Bland de första finns derivat av fosfin i vilka väteatomer ersätts med en eller flera organiska radikaler. Denna grupp innefattar även fosfinoxider (R 3 PO), alkylphosphinic syror (R 2 PO (OH)) och alkylfosfonsyra syror (R-PO (OH) 2 ) eller deras salter. Exempel på den andra gruppen är estrar av fosfinsyra , fosfonsyra eller fosforsyra , vilka kallas fosfiter , fosfonater eller fosfater . Organiska fosforföreningar - till exempel trifenylfosfin , fenyldiklorofosfin eller fosforylider - spelar en roll i många organiska reaktioner, t.ex. B. Wittig -reaktionen spelar en viktig roll.
Inom biokemi är fosforsyraestrarna särskilt relevanta. De är en viktig del av många metaboliska processer och en del av DNA . Viktiga molekyler är:
litteratur
- John Emsley: Fosfor - ett element av liv och död . Weinheim 2001, ISBN 3-527-30421-5 .
- Harry H. Binder: Lexikon för de kemiska elementen - det periodiska systemet i fakta, siffror och data . Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3 .
- F. Krafft: Fosfor. Från lätt materia till det kemiska elementet. I: Angewandte Chemie . 81 (17/18), 1969, sid. 634-645; doi: 10.1002 / anie.19690811703 .
- Ludwig Maier: Fosforföreningar och deras tekniska betydelse. I: Kemi i vår tid . 9: e året, nr 4, 1975, sid. 109-116; doi: 10.1002 / ciuz.19750090403 .
- Jochen Metzger: Fosfor -tidsbomb. Om denna råvara tar slut hotar apokalypsen. I: PM -kunskapsvärlden. Nr 8, 2010, ISSN 1863-9313 , s. 58-64.
webb-länkar
- Tyska fosforplattformen DPP eV - Nätverk för främjande av återvinning av fosfor och hållbar användning av de återvunna produkterna
- CEEP Phosphates TU-Darmstadts webbplats och CEEP för fosforåtervinning
- Fosforkrisen - slutet på mänskligheten? TV -dokumentär av art , maj 2013, regisserad av Christiane Schwarz och Marcel Weingärtner
- Fosfatreserver Föreläsning om globala reserver, gruvdrift, konsumtion och prisutveckling (PDF; 3,3 MB)
Individuella bevis
- ↑ a b Harry H. Binder: Lexikon för de kemiska elementen. S. Hirzel Verlag 1999, ISBN 3-7776-0736-3 .
- ↑ Värdena för fastigheterna (inforuta) är hämtade från www.webelements.com (fosfor) , om inte annat anges .
- ^ IUPAC, Standard Atomic Weights Revised 2013 .
- ↑ a b c d e post on phosphorus in Kramida, A., Ralchenko, Yu., Reader, J. and NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1) . Utg.: NIST , Gaithersburg, MD. doi : 10.18434/T4W30F ( https://physics.nist.gov/asd ). Hämtad 11 juni 2020.
- ↑ a b c d e Post om fosfor på WebElements, https://www.webelements.com , åtkomst den 11 juni 2020.
- ↑ en b c d e f Protokolls tetraphosphorus (vit fosfor) i GESTIS substansen databas den IFA , nås den 9 augusti 2016. (JavaScript krävs)
- ↑ en b c d Entry på fosfor, röd i GESTIS substansen databas den IFA , nås den 9 augusti 2016. (JavaScript krävs)
- ^ AF Holleman , E. Wiberg , N. Wiberg : Lärobok i oorganisk kemi . 102: e upplagan. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 747.
- ↑ a b David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90: e upplagan. (Internetversion: 2010), CRC Press / Taylor och Francis, Boca Raton, FL, Egenskaper för elementen och oorganiska föreningar, s. 4-142-4-147. Värdena där är baserade på g / mol och anges i cgs -enheter. Värdet som anges här är SI -värdet beräknat från det, utan måttenhet.
- ↑ a b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Korrigerade värden för kokpunkter och entalpier för förångning av element i handböcker. I: Journal of Chemical & Engineering Data. 56, 2011, s. 328-337, doi: 10.1021 / je1011086 .
- ↑ Entry på röd / vit fosfor i klassificerings- och märknings av den Europeiska kemikaliemyndigheten (ECHA), nås den 14 december, 2016. Tillverkare eller distributörer kan expandera en harmoniserad klassificering och märkning .
- ↑ Swiss Accident Insurance Fund (Suva): Gränsvärden-aktuella MAK- och BAT-värden (sök efter 12185-10-3 eller fosforvitt / gult ), öppnade den 2 november 2015.
- ^ A b Nationell teknisk informationstjänst. Volym AD-B011-150.
- ↑ a b c d Post på fosfor i ChemIDplus -databasen i United States National Library of Medicine (NLM)
- ^ Officiell kompendium för bekämpningsmedel. Association of the American Pesticide Control Officials, Inc., 1966, s. 901.
- ↑ American Heart Journal . Vol. 84, 1972, s. 139.
- ^ Arkiv för internmedicin . Vol. 83, 1949, s. 164.
- ^ Alphons Oppenheim: Brand, Hennig . I: Allgemeine Deutsche Biographie (ADB). Volym 3, Duncker & Humblot, Leipzig 1876, s. 236.
- ↑ Alexander P. Hardt: Pyroteknik. Pyrotechnica Publications, Post Falls, Idaho, 2001, ISBN 0-929388-06-2 , s. 74 ff.
- ^ Mary Weeks, Discovery of the elements, Journal of Chemical Education 1956, s. 135.
- ^ Schrötter, ny modifiering av fosfor , Liebigs Annalen der Chemie, volym 68, 1848, s. 247-253
- ↑ Anton Schrötter: Om ett nytt allotropiskt tillstånd av fosfor . I: JC Poggendorff (red.): Annals of Physics and Chemistry, tredje serien . 157 (Pogg. Ann. 81), nr. 10 . Johann Ambrosius Barth, 1850, ISSN 1521-3889 , sid. 276–298 , doi : 10.1002 / andp.18501571009 ( online på Gallica Bibliothèque nationale de France ).
- ^ W. Hittorf, Om kunskapen om fosfor , Annalen der Physik, volym 202, 1865, s. 193-228
- ↑ Bridgman, Två nya modifieringar av fosfor , Journal of the American Chemical Society, volym 36, 1914, s. 1344-1363.
- ^ A b A. F. Holleman , E. Wiberg , N. Wiberg : Textbook of oorganisk kemi . 91: a - 100: e, förbättrad och kraftigt utökad upplaga. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3 , s. 928-931.
- ↑ "Fosforutarmning: Bakteriesyrabyggare - härskare över liv och död?" (Schattenblick, 15 april 2008).
- ↑ “ Jordens tillgängliga fosfatreserver, som är huvudingrediensen i gödningsmedel, kan ta slut inom de närmaste 50 till 130 åren ”, i: A blooming waste, Website University of Technology, Sydney , 6 november 2006; alternativt: ” Tömningen av nuvarande ekonomiskt exploaterbara reserver uppskattas till någonstans från 60 till 130 år. Med hjälp av uppskattningarna av medianreserverna och under rimliga förutsägelser verkar det som att fosfatreserverna skulle hålla i minst 100+ år ”; i Arne Haarr, EUREAU (European Union of National Associations of Water Suppliers and Waste Water Services): Återanvändning av fosfor .
- ↑ Förbundsregeringens svar på den mindre frågan från parlamentsledamöterna Cornelia Behm, Friedrich Ostendorff, Dorothea Steiner, andra parlamentsledamöter och parlamentarikergruppen Alliance 90 / De gröna , tyska förbundsdagen, 15 december 2012, öppnade den 27 augusti 2019.
- ↑ Fosfat vid USGS Mineral Resources .
- ↑ M. Okrusch, S. Matthes: Mineralogie: En introduktion till speciell mineralogi, petrologi och deponeringsvetenskap. 7: e upplagan. Springer, 2005, ISBN 3-540-23812-3 .
- ↑ Medieförmedling från byggnadsavdelningen i Zürichs kanton: Omvandling av avloppsslam till råvara: Ny process lämplig för industriell produktion. 3 juni 2019, åtkomst 14 oktober 2019 .
- ↑ Odenwalds universum: Innebär bristen på fosfor slutet på mänskligheten? på: focus.de , 9 maj 2008.
- ↑ Dietmar Kunath: Fosofor. I: Claus Schaefer, Torsten Schröer (Hrsg.): Akvaristikens stora lexikon. Eugen Ulmer, Stuttgart 2004, ISBN 3-8001-7497-9 , s. 772.
- ^ A. Matthew et al.: Bevis för reaktiva reducerade fosforarter i det tidiga arkeiska havet. I: PNAS. 110 (25), 2013, s. 10089-10094. PMID 23733935 ; pdf (gratis fulltextåtkomst)
- ↑ Astronomer avslöjar interstellar tråd av en av livets byggstenar (en) . I: phys.org . Hämtad 28 september 2020.
- ^ Kometer förde fosfor - en byggsten i livet - till jorden (de) . 20 januari 2020. Åtkomst 28 september 2020.
- ^ VM Rivilla, MN Drozdovskaya, K. Altwegg, P. Caselli, MT Beltrán, F. Fontani, FFS van der Tak, R. Cesaroni, A. Vasyunin, M. Rubin, F. Lique, S. Marinakis, L. Testi , ROSINA-teamet: ALMA- och ROSINA-detektioner av fosforbärande molekyler: den interstellära tråden mellan stjärnbildande regioner och kometer . I: Månatliga meddelanden från Royal Astronomical Society . 11 februari 2020, s. 1180–1198. arxiv : 1911.11647 . doi : 10.1093 / mnras / stz3336 .
- ↑ Inmatning av fosfor. I: Römpp Online . Georg Thieme Verlag, åtkomst den 13 januari 2015.
- ^ Soda Springs. ( Memento den 24 juli 2016 i Internetarkivet ) på: monsanto.com
- ↑ Federal contract site avslöjar USA: s beroende av Monsanto och det israeliska företaget för leverans av vit fosfor , 7 februari 2013.
- ↑ Horst Briehl: Materialkemi . Springer-Verlag, 2014, ISBN 978-3-658-06225-5 , s. 24 ( begränsad förhandsvisning i Google boksökning).
- ↑ Ralf Steudel : Kemi av icke-metaller från struktur och bindning till tillämpning . Walter de Gruyter, 2008, ISBN 978-3-11-021128-3 , sid. 360 ( begränsad förhandsvisning i Google boksökning).
- ↑ Brandi M. Cossairt, Christopher C. Cummins, Ashley R. Head, Dennis L. Lichtenberger, Raphael JF Berger, SA Hayes, NW Mitzel, G. Wu,: On the Molecular and Electronic Structures of AsP 3 and P 4 . I: Journal of the American Chemical Society . tejp 132 , nr. 24 , 23 juni 2010, ISSN 0002-7863 , sid. 8459-8465 , doi : 10.1021 / ja102580d ( acs.org [åtkomst 3 juli 2020]).
- ↑ Alfons Klemenc: Oorganisk kemi på fysikalisk-kemisk grund . Springer-Verlag, 2013, ISBN 978-3-7091-7793-8 , s. 202 ( begränsad förhandsvisning i Google boksökning).
- ↑ Stefanie Ortanderl, Ulf Ritgen: Chemistry for Dummies. Läroboken . John Wiley & Sons, 2014, ISBN 978-3-527-70924-3 , s. 541 ( begränsad förhandsvisning i Google boksökning).
- ^ Dietrich Wertz: Luminescens . diplom.de, 2004, ISBN 3-8324-8284-9 , sid. 29 ( begränsad förhandsvisning i Google boksökning).
- ↑ retro; haklapp - Sida från handboken för läkemedelspraxis : skadedjurskurer.
- ↑ J. Sedlmeyer: Om fosforförgiftning. I: Tysk tidskrift för all rättsmedicin. Volym 19, nr 1, december 1932, s. 365-383; ( doi: 10.1007 / BF01750213 ).
- ↑ Broschyr på BK nr 1109: Sjukdomar orsakade av fosfor eller dess oorganiska föreningar , meddelande om BMA den 25 februari 1981, BArbBl Heft 4/1981.
- ↑ Hur kopparsulfatlösning fungerar vid avgiftning av vit fosfor. på: www.chemieunterricht.de .
- ↑ Stefan Lange, Peer Schmidt, Tom Nilges: Au 3 SnP 7 @Black Phosphorus: En enkel åtkomst till svart fosfor. I: Inorg. Chem. 46 (10), 2007, sid. 4028-4035; doi: 10.1021 / ic062192q .
- ↑ G. Brauer (red.): Handbok i preparativ oorganisk kemi. 2: a upplagan. Vol. 1, Academic Press 1963, s. 518-525.
- ↑ Grunder och huvudgruppselement Volym 1: Grunder och huvudelement . Walter de Gruyter GmbH & Co KG, 2016, ISBN 3-11-049585-6 , s. 852 ( begränsad förhandsvisning i Google boksökning).
- ↑ H. Thurn, H. Krebs: Om halvmetallers struktur och egenskaper. XXII. Kristallstrukturen för Hittorfs fosfor. I: Acta Cryst. B25, 1969, sid. 125-135.
- ↑ H. Thurn: Kristallstrukturen för Hittorfs fosfor. Avhandling . Tekniska universitetet i Stuttgart, 1967.
- ↑ Arno Pfitzner, Michael F. Bräu, Josef Zweck, Gunther Brunklaus, Hellmut Eckert: Phosphorus Nanorods - Two Allotropic Modifications of a Long -Known Element. I: Angew. Chem. Int. Ed. 43, 2004, sid. 4228-4231; doi: 10.1002 / anie.200460244 .
- ↑ E.-C. Koch: Specialmaterial i pyroteknik: IV. Fosforens kemi och dess föreningar. I: J. Pyrotech. 21, 2005, s. 39; Abstrakt .
- ↑ E.-C. Koch: Specialmaterial inom pyroteknik: V. Militära tillämpningar av fosfor och dess föreningar. I: Drivmedel Explos. Pyrotech. 33, 2008, s. 165; doi: 10.1002 / prep.200700212 .
- ↑ Dietmar Kunath: Fosfor. I: Claus Schaefer, Torsten Schröer (Hrsg.): Akvaristikens stora lexikon. 2 volymer. Eugen Ulmer, Stuttgart 2004, ISBN 3-8001-7497-9 , 772.
- ↑ Emanuel Epstein: Anomaly of Silicon in Plant Biology. I: Proc. Natl. Acad. Sci. USA 91, 1994, s. 11; doi: 10.1073 / pnas.91.1.11 .
- ↑ Lincoln Taiz, Eduardo Zeiger: Växternas fysiologi. Spectrum, Akad. Verlag, Heidelberg / Berlin 1998, ISBN 3-8274-0537-8 .
- ↑ K. Mengel: Växtens näring och metabolism. Gustav Fischer Verlag, Jena 1991, s. 324–334.
- ↑ Ammunitionsrester: Granater i Östersjön. ( Memento den 14 mars 2008 i Internetarkivet ) på: sueddeutsche.de , 9 januari 2008.
- ↑ Rester av ammunition i Östersjön. ”Myndigheterna visar inget intresse”. på: sueddeutsche.de , 8 januari 2008.
- ↑ Stefan Nehring: Ammunitionsolyckor - och inget slut. på: travemuende-aktuell.de , 2015.
- ↑ DGUV.de: BGR / GUV-SR 2003 Undervisning i skolor med farliga ämnen (onlineversion; PDF-fil; 9,52 MB), s. 24, tillgänglig 25 april 2011.
- ^ A b Nils Wiberg, Egon Wiberg, Arnold Frederik Hollemann: Inorganische Chemie . Volym 1: Grunder och huvudgruppselement. 103: e upplagan. De Gruyter, Berlin, Boston 2017, ISBN 978-3-11-051854-2 , s. 783 ff . (nås via De Gruyter Online)























![{\ displaystyle {\ ce {PO4 ^ 3- + 12MoO4 ^ 2- + 24H3O + + 3NH4 + <=> (NH4) 3 [P (Mo3O10) 4] + 36 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb26219c3cab9f7c0612f33ef53af1422e1214ff)


![{\ displaystyle {\ ce {H2PO4- + 12 [MoO2Cl3 (H2O)] + 26 H2O-> [P (Mo3O10) 4] ^ 3- + 26 H3O + + 36Cl-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6363079e9a055be6d511005c74fb931ca9f8abd5)
![{\ displaystyle {\ ce {[P (Mo3O10) 4] ^ 3- + 3HOx + 3H3O + -> (H2Ox) 3 [P (Mo3O10) 4] + 3H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3f23c5ca64a72c9d6438fce291f757851636270c)
![\ mathrm {(H_2Ox) _3 [P (Mo_3O_ {10}) _ 4] \ cdot x \ H_2O}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b4a4ac6f7c69607fc6cb08462cc8acb0da733f77)
![\ mathrm {(H_2Ox) _3 [P (Mo_3O_ {10}) _ 4]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4015e1b4d1a83dc0b2c857e26fa6cdef99a7a9da)